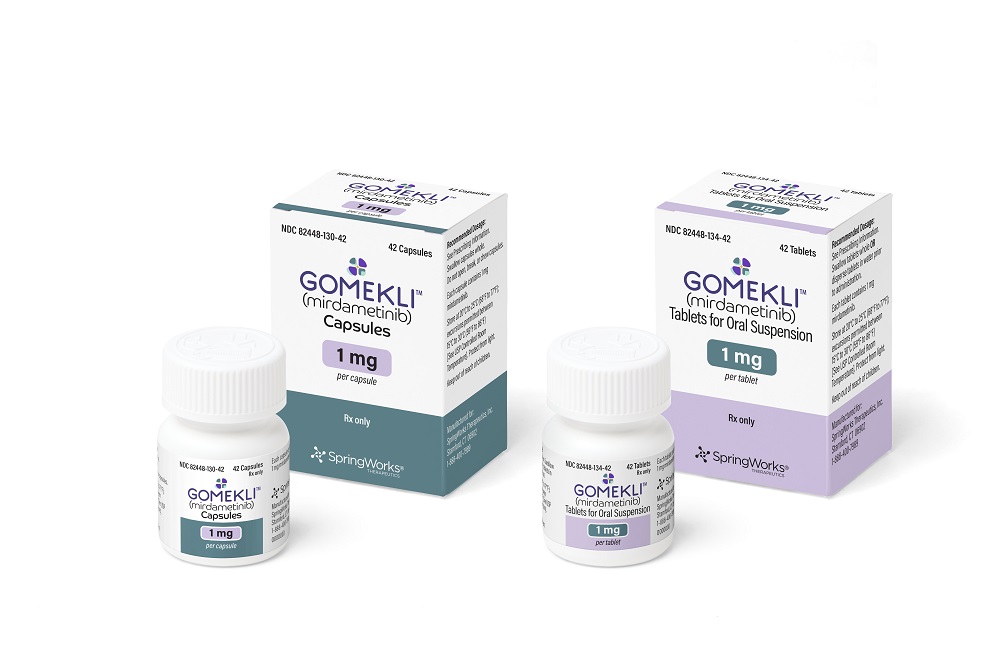
Eine genetische Erkrankung, bei der sich Tumoren am Nerven bilden, hat eine neue von der FDA zugelassene Behandlung, ein Springworks-Therapeutika, das eine breitere Palette von Patienten ansprechen kann als das AstraZeneca-Produkt, das zuerst diese seltene Störung behandelte.
Die Krankheit, Neurofibromatose Typ 1 (NF1), ist technisch nicht Krebs, da die bilden Tumoren gutartig sind. NF1 kann jedoch zu Krebsarten führen. Auch wenn die Tumoren eines Patienten nicht krebsartig sind, sind sie schmerzhaft und entstellen. Die FDA -Zulassung gab am Dienstag die Behandlung von NF1 -Tumoren ab, die nicht chirurgisch entfernt werden können. Das in der Entwicklung als Mirdametinib bezeichnete Medikament wird unter dem Markennamen Gomekli vermarktet. Springworks erwartet, dass das neue Produkt innerhalb von zwei Wochen erhältlich wird.
In Stamford, in Connecticut ansässigem Springworks, schätzt 100.000 Menschen weltweit NF1. Etwa 40.000 dieser Patienten sind in den USA. Die Krankheit stammt aus Mutationen im NF1 -Gen, das für einen Proteinschlüssel zur Unterdrückung von MAPK kodiert, ein Weg, der beim Hyperaktivieren das Krebswachstum antreibt. Tumoren, die aus den Mutationen resultieren, sind normalerweise aggressiv und wachsen während der Kindheit eines Patienten schnell. Eine Operation ist die erste Behandlungsoption, aber die Lage von Tumoren bei oder in der Nähe von lebenswichtigen Strukturen oder Organen kann diese Wahl riskant machen. Off-Label-Arzneimitteloptionen umfassen Krebsmedikamente wie Chemotherapie und Immuntherapie.
Gomekli ist ein orales kleines Molekül, das Mek1 und MEK2 blockiert, zwei Proteine, die im MAPK -Weg Schlüsselrollen spielen. MEK -Inhibitoren wurden bereits für die Behandlung bestimmter Krebsarten zugelassen. Koselugo, das AstraZeneca -Medikament, das die erste von der FDA zugelassene NF1 -Therapie im Jahr 2020 wurde, ist ein MEK -Inhibitor, der ursprünglich in verschiedenen festen Tumoren getestet wurde. In NF1 ist Koselugo nur zur Behandlung von pädiatrischen Patienten ab 2 und älter zugelassen. Das Springworks -Medikament hat einen Vorteil bei der Zulassung, die die Behandlung von Erwachsenen und Kindern abdeckt.
Die FDA-Entscheidung für Gomekli basierte auf den Ergebnissen einer einarmigen Phase-2-Studie, in der 114 Patienten-58 Erwachsene und 56 Kinder-mit symptomatischen, nicht operierbaren NF1-assoziierten Tumoren eingeschlossen wurden. Das Hauptziel war es, das Verschwinden oder Verringerung von Tumoren zu messen. Die Ergebnisse zeigten, dass die Gesamtansprechrate bei Erwachsenen 41% und bei Kindern 52% betrug. Die häufigsten Nebenwirkungen waren Hautausschlag, Durchfall, Übelkeit und Muskelschmerzen.
Die Studienergebnisse wurden im vergangenen November im Journal of Clinical Oncology veröffentlicht. Dr. Christopher Moertel, medizinische Direktor für pädiatrische Neuro-Onkologie- und Neurofibromatose-Programme an der Universität von Minnesota und leitender Forscher der klinischen Studie von Reneu, sagte NF1-Patienten, die sich mit erheblichen gesundheitlichen Herausforderungen und begrenzten Behandlungsoptionen befinden.
„In der Reneu -Studie war es sehr ermutigend zu sehen, dass Gomekli tiefe und dauerhafte Reaktionen mit einem überschaubaren Sicherheitsprofil ermöglichte, das den Patienten ermöglichte, bei der Therapie zu bleiben“, sagte Moertel in der Ankündigung von Springworks. „Diese Zulassung stellt einen wichtigen Fortschritt dar, insbesondere für Erwachsene, die zuvor keine zugelassene Behandlung hatten.“
Gomekli ist sowohl als Kapsel als auch als Tablette erhältlich, das in Wasser verschluckt oder gemischt werden kann. Das zweimal tägliche Medikament ist in zwei Dosierungsstärken erhältlich. Die präzise Dosierung wird durch die Körperoberfläche eines Patienten unter Berücksichtigung von Größe und Gewicht bestimmt. Springworks legte laut einer Anmeldung am Mittwoch einen Großhandelspreis von 206,25 USD pro mg fest. Das Unternehmen schätzt, dass die durchschnittlichen Behandlungskosten für pädiatrische Patienten und 30.000 USD pro Monat für Erwachsene etwa 22.000 USD pro Monat betragen.
Die Gomekli -Zulassung kommt, als Springworks ein potenzielles Erwerbsziel für Merck KGAA entwickelt hat. Nach einem Reuters -Bericht über Verhandlungen für einen Deal gab die deutsche Gesellschaft am Montag eine Erklärung ab, in der fortgeschrittene Diskussionen mit Springworks bestätigt wurden. Merck KGAA sagte jedoch, dass die Unternehmen keine rechtsverbindliche Vereinbarung geschlossen haben, und fügte hinzu, dass „kritische Bedingungen noch nicht erfüllt sind“.
Wenn Merck KGAA einen Deal für Springworks abschließen kann, wird es mehr als das neue NF1 -Medikament erhalten. Im Jahr 2023 erhielt das Springworks Drug OgSiveo die FDA -NOD für die Behandlung von Desmoid -Tumoren, eine seltene Art von Tumor, die das Bindegewebe beeinflusste. Für die neun Monate am 30. September 2024 machte OgSiveo nach dem jüngsten Finanzbericht der Biotech 110 Millionen US -Dollar um Einnahmen aus. Sowohl Ogsiveo als auch Gomekli wurden ursprünglich von Pfizer entwickelt, das sie 2017 in das eigenständige Unternehmen Springworks einspannte.
Abgesehen von NF1 testet Springworks Gomekli bei bestimmten Krebsarten. Als Monotherapie hat das Arzneimittel bei pädiatrischen Gliomen mit niedriggradigem Stadium klinische Tests in der mittleren Stufe erreicht. Unter einer Partnerschaft mit Beimene wird Gomekli auch in soliden Tumoren getestet, die von Ras- und RAF -Mutationen angetrieben werden. Eine Phase -1 -Studie bewertet das Springworks -Medikament in Kombination mit dem experimentellen Lifirafenib von Beimene, einem kleinen Molekül -Inhibitor von RAF -Enzymen.
Foto von Springworks Therapeutics