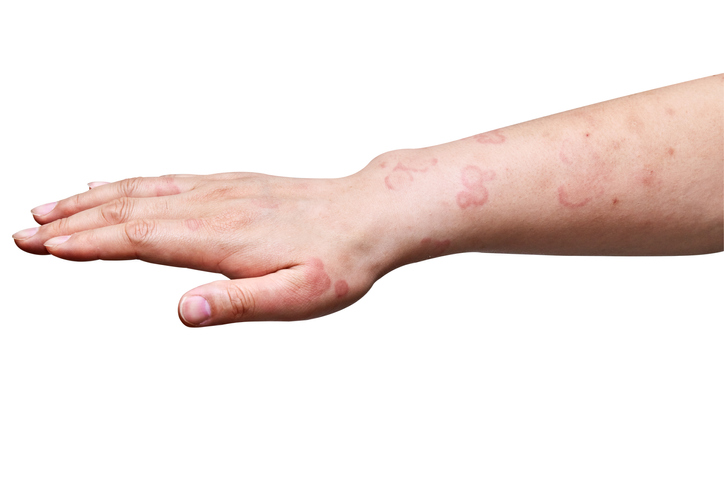
Sanofi und Regeneron Pharmaceuticals Medikamente Dupixent haben die FDA -Zulassung für chronische spontane Urtikaria erhalten und einen neuen Ansatz zur Behandlung dieser entzündlichen Hauterkrankung eingeführt. Es ist die siebte von der von der FDA zugelassene Indikation für das Blockbuster -Produkt.
Die regulatorische Entscheidung gab am Freitag die Behandlung von Patienten ab 12 Jahren ab, deren chronische spontane Urtikaria (CSU) -Symptome trotz der Behandlung mit Antihistaminika standardmäßiger Beteiligung fortgesetzt werden.
Die CSU wird teilweise nach Entzündungen vom Typ 2 angetrieben, eine Art überaktiver Immunantwort. Diese Antwort führte zu Bienenstöcken und Juckreiz; CSU ist als Krankheit definiert, die länger als sechs Wochen dauert. Sanofi schätzt, dass 1,7 Millionen Menschen in den USA von der CSU betroffen sind. Trotz der breiten Verfügbarkeit von Antihistaminika hat das Unternehmen etwa die Hälfte der CSU -Patienten eine Krankheit aufweist, die von diesen Standardbehandlungen unzureichend kontrolliert wird.
Antihistaminika zielen auf H1 -Rezeptoren ab, Rezeptoren auf Immunzellen, die eine Rolle bei der Immunantwort und Entzündung spielen. Die zweite Behandlungsoption für die CSU ist Genentechs Xolair, ein Asthma-Medikament, das seine Zulassung auf die entzündliche Hautstörung im Jahr 2014 erweiterte. Xolair ist ein Antikörper, um die Immunoglobulin-E-Rezeptoren zu blockieren, die an allergischen Reaktionen und Immunreaktionen beteiligt sind. Aber andere Wege spielen eine Rolle in der CSU. Dupixent, ein Medikament, das alle zwei Wochen durch Injektion verabreicht wird, ist ein monoklonaler Antikörper, der die Signalwege IL-13 und IL-4 blockiert.
Die FDA-Zulassung von Dupixent in CSU basiert auf den Ergebnissen von zwei Phase-3-Tests, die das Medikament als Add-On zu Antihistaminika im Vergleich zu einem Placebo und Antihistaminika bewerteten. Die Ergebnisse zeigten, dass DuPixent die primären und sekundären Ziele der Reduzierung der Juckreiz- und Juckreiz- und Hive -Aktivität im Vergleich zum Kontrollarm nach 24 Wochen erreicht hat. Der Studienmedikamentenarm zeigte auch eine erhöhte Wahrscheinlichkeit einer gut kontrollierten Erkrankung oder einer vollständigen Reaktion nach 24 Wochen. In Bezug auf die Sicherheit stimmten die Ergebnisse mit dem bekannten Sicherheitsprofil von Dupixent in seinen genehmigten Indikationen überein. Das häufigste berichtete unerwünschte Ereignis waren die Reaktionen für Injektionsstelle.
DuPixent wurde erstmals 2017 als Behandlung bei atopischer Dermatitis zugelassen. Es ist das meistverkaufte Produkt von Sanofi, das im Jahr 2024 mehr als 13 Milliarden Euro (ca. 14,7 Milliarden US-Dollar) ausmacht. Die Entzündungs- und Immunologie-Strategie von Sanofi umfasst die Erweiterung des Arzneimittels auf andere Indikationen. Im vergangenen Jahr haben die Europäische Arzneimittelkommission und die FDA Dupixent für chronisch obstruktive Lungenerkrankungen zugelassen.
„Diese FDA -Zulassung bietet eine neue Behandlungsoption, um die zugrunde liegenden Treiber dieser schwerwiegenden und wiederkehrenden Anzeichen und Symptome anzugehen“, sagte Alyssa Johnsen, Global Therapeutic Area Head, Immunology und Oncology Development bei Sanofi, in einer vorbereiteten Erklärung. „DuPixent hat das Potenzial, die Ergebnisse für CSU -Patienten zu verbessern, die zuvor nur begrenzte Behandlungsoptionen hatten.“
Im Jahr 2023 lehnte die FDA die erste Anwendung von Sanofi für das Arzneimittel in der CSU ab und bat um weitere klinische Daten, um die Wirksamkeit zu zeigen. Diese Einreichung basierte auf zwei Phase -3 -Studien, von denen eines das Hauptziel des Hauptversuchs nicht erreichte. Die Wiederherstellung enthielt Daten aus einem dritten Phase -3 -Test. DuPixent ist für die CSU in Japan, die Vereinigten Arabischen Emirate und Brasilien zugelassen. Das Medikament wird in diesem Hinweis in Europa und anderen Märkten auf der ganzen Welt noch überprüft.
Es gibt andere Unternehmen, die versuchen, neue Ansätze zur Behandlung von CSU zu veranlassen. Celldex Therapeutics befindet sich in der klinischen Entwicklung im späten Stadium mit Barzovolimab, einem Antikörper-Arzneimittel, das an den Kit-Rezeptor an Mastzellen gebunden ist. Evommune zielt darauf ab, die Aktivierung von Mastzellen mit einem oralen kleinen Molekül, EVO756, zu beheben. Als das Startup im vergangenen Oktober eine Finanzierung der Serie C in Höhe von 115 Millionen US -Dollar enthielt, erwartete es in der ersten Halbzeit von 2025 vorläufige Phase -2b -Daten in der CSU.
Die CSU -Arzneimittelforschung hat jedoch auch zu Misserfolgen geführt. Im Jahr 2022 zeigten die dritte harmonische Entwicklung eines oralen kleinen Molekül -Kit -Inhibitors nach Phase 1 -Daten Anzeichen einer potenziellen Leber -Toxizität. Das Unternehmen konzentrierte sich auf ein anderes Kit-Blocking-kleines Molekül, THB335, das derzeit für die Entwicklung der Phase 2 vorbereitet ist. Letzte Woche kündigte Third Harmonic Pläne an, das Unternehmen aufzulösen und sein Vermögen, einschließlich THB335, zu verkaufen, die die Aktionäre zurücksenden.
In der Zwischenzeit hat Allakos zweimal zu kurz gekommen, um Antikörper zu entwickeln, die Mastzellen hemmen. Im vergangenen Jahr berichtete Allakos, dass sein Medikament Lirentelimab in einem Phase -2 -Test in der CSU kein Placebo geschlagen habe. Die Biotech konzentrierte sich auf ein anderes Medikament, AK006. Das Versagen dieses Arzneimittels im Januar im Januar löste jedoch die zweite Unternehmensumstrukturierung der Biotech im vergangenen Jahr aus.
Foto: Getty Images