Neun Monate nach seiner Einführung in den USA stößt das Alzheimer-Medikament Leqembi von Eisai und Biogen bei seiner breiten Einführung auf erheblichen Widerstand, was vor allem auf die Skepsis einiger Ärzte hinsichtlich der Wirksamkeit der Behandlung dieser degenerativen Hirnerkrankung zurückzuführen ist.
Obwohl es sich um das erste Medikament handelt, das nachweislich das Fortschreiten der Alzheimer-Krankheit verlangsamt, erweisen sich bei Gesundheitsdienstleistern tief verwurzelte Zweifel am Nutzen der Behandlung der Erkrankung als großes Hindernis.
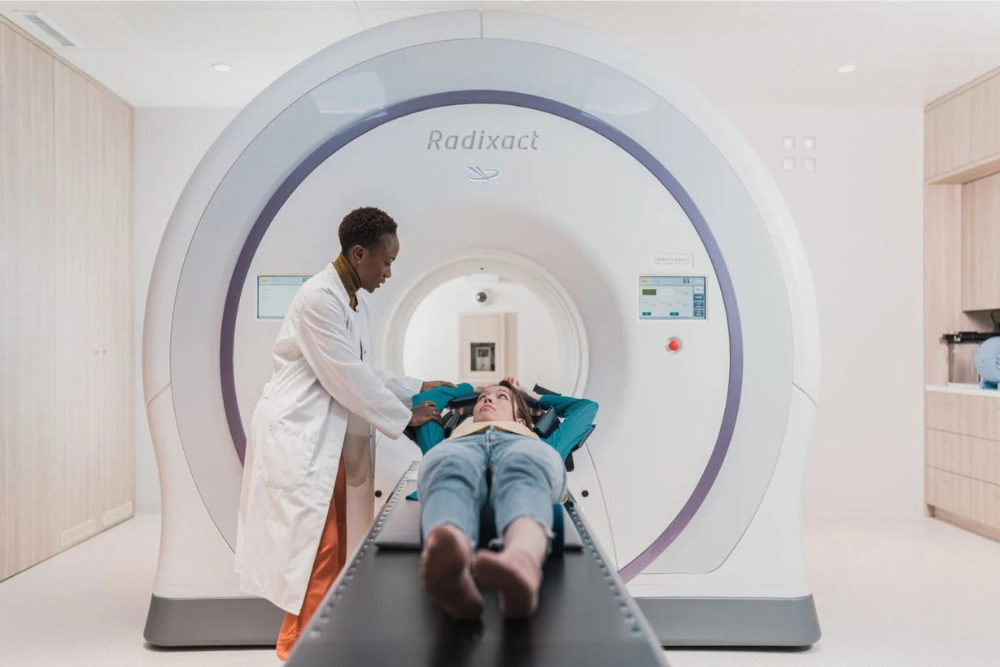
Alzheimer-Spezialisten rechneten zunächst mit Herausforderungen im Zusammenhang mit dem anspruchsvollen Protokoll von Leqembi, das zusätzliche Diagnosetests, zweimonatliche Infusionen und regelmäßige Gehirnscans zur Überwachung auf potenziell schwerwiegende Nebenwirkungen umfasst. Tatsächlich haben diese Anforderungen dazu beigetragen, dass das Medikament seit seiner Zulassung durch die US-amerikanische Lebensmittel- und Arzneimittelbehörde nur langsam angenommen wird, wie Gespräche mit 20 Neurologen und Geriatern in verschiedenen US-Regionen belegen.
Laut Reuters äußerten sieben Ärzte ihre Zurückhaltung bei der Verschreibung von Leqembi und begründeten dies mit Zweifeln an der Wirksamkeit des Medikaments, seinen Kosten und den damit verbundenen Risiken. Darüber hinaus wies eine Gruppe von sechs führenden Experten auf diesem Gebiet darauf hin, dass der „therapeutische Nihilismus“ – die Wahrnehmung, dass Alzheimer eine unüberwindbare Krankheit sei – einen größeren Einfluss als erwartet auf die Eindämmung der Begeisterung bei Hausärzten, Geriatern und Neurologen hat. Diese Skepsis beeinträchtigt ihre Bereitschaft, Patienten für eine mögliche Behandlung mit Leqembi an Gedächtnisspezialisten zu überweisen.
Einige Experten sagen, dass die Zurückhaltung einiger Ärzte auf die lange Zeit des Zweifels zurückzuführen sein könnte, die die Wirksamkeit der gezielten Bekämpfung des Alzheimer-Proteins Beta-Amyloid zur Verlangsamung des Fortschreitens der Krankheit getrübt hat. Vor den ermutigenden Ergebnissen der Leqembi-Studie hielten viele im medizinischen Bereich diese Forschungsrichtung für unfruchtbar.
Andere Mediziner haben Bedenken hinsichtlich der Nebenwirkungen von Leqembi geäußert, wie z. B. Hirnschwellungen und Blutungen, zusätzlich zu den Kosten, die mit dem Jahrespreis von 26.500 US-Dollar, häufigen MRTs und zweimonatlichen Infusionen verbunden sind.
Leqembi war das erste auf Amyloid gerichtete Medikament, das die vollständige FDA-Zulassung erhielt, nachdem in klinischen Studien eine Verlangsamung des kognitiven Abbaus bei Alzheimer-Patienten im Frühstadium um 27 % nachgewiesen wurde. Trotz des ursprünglichen Ziels, bis Ende März 10.000 Amerikaner zu behandeln, hatten bis Ende Januar nur wenige Tausend mit der Behandlung begonnen, wie Eisai berichtete, dessen Sprecherin es ablehnte, aktualisierte Zahlen zu nennen.
Die Einführung neuer Medikamente verläuft äußerst langsam, selbst wenn sie keine wesentlichen Änderungen in der medizinischen Praxis erfordern. Untersuchungen haben gezeigt, dass es durchschnittlich 17 Jahre dauern kann, bis klinische Forschung zur Routine wird. Über 6 Millionen Amerikaner sind von Alzheimer betroffen, dennoch empfehlen weniger als die Hälfte der US-amerikanischen Neurologen ihren Patienten Leqembi, wie aus einer Januar-Umfrage des Life-Science-Marktforschers Spherix Global Insights hervorgeht.
Geschrieben von Alius Noreika
source link eu news